绘谱学堂六周年啦,六载深耕,绘谱学堂始终致力于搭建高水平的学术交流平台,已成功举办70+场线上专题学术讲座,诚挚感谢70+位嘉宾和科研同仁们的一路同行!绘谱学堂六年来秉持 “技术前沿性、机制深度性、功能验证性、转化实用性”,特邀70+位在国际权威期刊发表原创高分论文的第一/通讯作者进行线上分享,全面解锁肝病、糖尿病与肥胖、饮食、神经退行性疾病、消化性疾病、肿瘤、中医药等多种疾病研究方向的奥秘,学术干货满满哦!
【六周年特别回馈】
我们系统梳理了往期绘谱学堂的课程内容,精心为大家准备了专题课程合辑大礼包,非酒精性脂肪肝、糖尿病/肥胖、肿瘤/癌症、消化道疾病、神经系统疾病、中医药研究、脂质组与脂肪酸、代谢流实验设计与应用、代谢组学数据获取与应用九大专题,全方位满足不同研究方向的需求,为各位研究者们献上一份学术厚礼,开启您的 “精准学术充电” 之旅吧!

【课包内容】

【活动要求】
解锁绘谱学堂超值课程礼包,2步即可轻松get!
第一步,将本篇文章或海报转发至您的朋友圈(要求无屏蔽无分组),让更多朋友一起解锁绘谱学堂的无限魅力;在转发的同时,欢迎您分享参加绘谱学堂的听课感受与收获,或是谈谈印象深刻的课程,或是期待的未来讲座主题等等……
第二步,把朋友圈分享截图发送至麦特绘谱工作人员微信号,即可领取课程礼包。

(工作人员微信)
* 本活动最终解释权归麦特绘谱所有。
【活动时间】
7月1日至9月30日,内容丰厚,机会难得,千万不要错过!
快来领取第五弹神经系统疾病与衰老专题课程资源包,关注麦特绘谱公众号下期精彩内容也不要错过,让绘谱学堂成为您突破研究瓶颈的“加速器”——毕竟,好的科研思路,永远值得被更多人看见!
【神经系统疾病与衰老专题内容回顾】
精神类疾病的病理机制探索正逐步突破传统神经调控框架,转向多系统交互的深度解析。当前研究表明,肠道菌群代谢紊乱、机体铁稳态失衡及全身性代谢重编程,可能通过 “肠-脑轴”“代谢-神经信号通路” 等多维机制,参与抑郁症、阿尔茨海默病等精神障碍的发生发展。
如今,研究者们正透过代谢的视角,解码这些看不见的关联:从菌群代谢物到身体里的 “铁平衡”,从代谢小分子到脑轴信号,一个个新发现正在为精神疾病的防治打开新思路。或许未来,管好身体里的 “小环境”,就能为心灵筑起更坚实的屏障!
《肠道来源宿主共代谢产物苯乙酰谷氨酰胺促进体内外细胞衰老》——杨浩 复旦大学
当岁月在皮肤上刻下痕迹时,肠道里的微生物世界也在悄悄 “改写” 衰老剧本。随着年龄增长,肠道菌群会加速生产一种叫苯乙酰谷氨酰胺(PAGln)的代谢物,它像个 “隐形推手”,通过干扰线粒体工作、破坏 DNA,让细胞提前进入 “退休” 状态。本研究揭示了菌群代谢物调控衰老的新机制,通过阻断 ADRs 或清除衰老细胞的干预实验,为开发靶向肠道代谢的抗衰老疗法提供了重要理论依据。
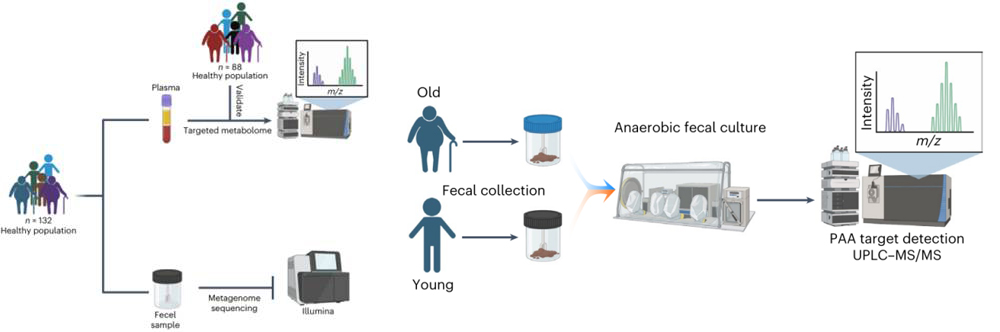
参考文献:Yang H, Wang T, Qian C, et al. Gut microbial-derived phenylacetylglutamine accelerates host cellular senescence. Nat Aging. 2025;5(3):401-418. doi:10.1038/s43587-024-00795-w
《应用代谢组学研究衰老机制的最新进展》——王晓艳 上海交通大学
代谢组学作为解析生命活动动态变化的重要工具,为衰老机制研究提供了全新视角。从肠道菌群代谢与长寿的关联,以及衰老相关特征性代谢小分子的作用,到多组学研究整合,揭示肠道菌群代谢重编程、特定代谢物,如胆汁酸、核苷酸衍生物等,在衰老进程中的调控作用,为理解衰老的分子机制、发现潜在抗衰老靶点及干预策略提供了系统性参考。
参考文献:
1.Zhu H, Li Q, Liao T, et al. Metabolomic profiling of single enlarged lysosomes. Nat Methods. 2021;18(7):788-798. doi:10.1038/s41592-021-01182-8
2.Aon MA, Bernier M, Mitchell SJ, et al. Untangling Determinants of Enhanced Health and Lifespan through a Multi-omics Approach in Mice. Cell Metab. 2020;32(1):100-116.e4. doi:10.1016/j.cmet.2020.04.018
3.Nie C, Li Y, Li R, et al. Distinct biological ages of organs and systems identified from a multi-omics study. Cell Rep. 2022;38(10):110459. doi:10.1016/j.celrep.2022.110459
4.Shuai M, Fu Y, Zhong HL, et al. Mapping the human gut mycobiome in middle-aged and elderly adults: multiomics insights and implications for host metabolic health. Gut. 2022;71(9):1812-1820. doi:10.1136/gutjnl-2021-326298
5.Xu Q, Wu C, Zhu Q, et al. Metagenomic and metabolomic remodeling in nonagenarians and centenarians and its association with genetic and socioeconomic factors. Nat Aging. 2022;2(5):438-452. doi:10.1038/s43587-022-00193-0
6.Sato Y, Atarashi K, Plichta DR, et al. Novel bile acid biosynthetic pathways are enriched in the microbiome of centenarians. Nature.2021;599(7885):458-464. doi:10.1038/s41586-021-03832-5
7.Ghosh TS, Shanahan F, O’Toole PW. The gut microbiome as a modulator of healthy ageing. Nat Rev Gastroenterol Hepatol. 2022;19(9):565-584. doi:10.1038/s41575-022-00605-x
8.Boehme M, Guzzetta KE, Bastiaanssen TFS, et al. Microbiota from young mice counteracts selective age-associated behavioral deficits. Nat Aging. 2021;1(8):666-676. doi:10.1038/s43587-021-00093-9
9.Levine DC, Hong H, Weidemann BJ, et al. NAD+ Controls Circadian Reprogramming through PER2 Nuclear Translocation to Counter Aging. Mol Cell. 2020;78(5):835-849.e7. doi:10.1016/j.molcel.2020.04.010
10.Liu Z, Li W, Geng L, et al. Cross-species metabolomic analysis identifies uridine as a potent regeneration promoting factor. CellDiscov. 2022;8(1):6. Published 2022 Feb 1. doi:10.1038/s41421-021-00361-3
11.Mossad O, Nent E, Woltemate S, et al. Microbiota-dependent increase in δ-valerobetaine alters neuronal function and is responsible for age-related cognitive decline. Nat Aging. 2021;1(12):1127-1136. doi:10.1038/s43587-021-00141-4
12.Zhang X, Yang Y, Su J, et al. Age-related compositional changes and correlations of gut microbiome, serum metabolome, and immune factor in rats. Geroscience. 2021;43(2):709-725. doi:10.1007/s11357-020-00188-y
13.Yang Y, Chen T, Zhang X, Wang X. Age-related functional changes of intestinal flora in rats. FEMS Microbiol Lett. 2021;368(10):fnab051. doi:10.1093/femsle/fnab051
《铁稳态与骨骼肌衰老和再生》——谢黎炜 广东省科学院微生物研究所
人老了为什么容易腰酸背痛?肌肉里的 “铁” 可能在悄悄作祟。衰老的骨骼肌会 “贪吃不消化”——Tfr1和Slc39a14这对 “转运搭档” 出错,导致铁离子在肌肉里堆积,引发细胞 “铁死亡”,加剧肌肉衰老与再生障碍,且看本研究揭示“铁”是如何调控骨骼肌衰老机制?又提供了哪些针对性的策略?
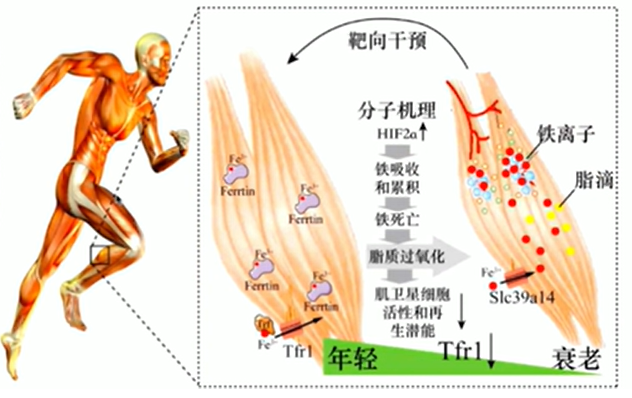
参考文献:Ding H, Chen S, Pan X, et al. Transferrin receptor 1 ablation in satellite cells impedes skeletal muscle regeneration through activation of ferroptosis. J Cachexia Sarcopenia Muscle. 2021;12(3):746-768. doi:10.1002/jcsm.12700
《阿尔茨海默病的诊疗机制研究》——陈天璐 上海市第六人民医院
记忆的橡皮擦如何悄悄擦去过往?阿尔茨海默病的谜团里,藏着代谢的 “蛛丝马迹”。基于中美大队列数据研究,系统探究 AD 进展规律,通过全面评估 AD 患者的代谢特征,提出胆固醇代谢紊乱、胆汁酸失衡及血氨异常可能是 AD 诊疗的新突破口。依托贾伟教授团队在精神疾病领域多年深耕积累,为解析AD 的代谢调控网络、开发新型诊断标志物及靶向治疗方案提供重要理论基础与临床启示。

贾伟教授团队AD等精神类疾病研究节点
参考文献:
1.Ren Z, Zhao L, Zhao M, et al. Increased intestinal bile acid absorption contributes to age-related cognitive impairment. Cell Rep Med. 2024;5(5):101543. doi:10.1016/j.xcrm.2024.101543
2.Chen T, Pan F, Huang Q, et al. Metabolic phenotyping reveals an emerging role of ammonia abnormality in Alzheimer’s disease. Nat Commun. 2024;15(1):3796. Published 2024 May 7. doi:10.1038/s41467-024-47897-y
《肠道菌群与高香草酸代谢在抑郁症治疗中的作用与机制》——赵明亮上海市第六人民医院
抑郁症是全球高发的精神障碍,肠道菌群-脑轴的调控作用为其治疗提供了新方向。本研究从临床队列多组学研究结果出发,抽丝剥茧地发现了HVA及B. longum、R. intestinalis的抗抑郁功效。日常生活中多多补充膳食纤维,或益生菌“鸡尾酒”疗法补充B. longum和R. intestinalis,或可为抑郁症的非药物治疗开辟全新视野。
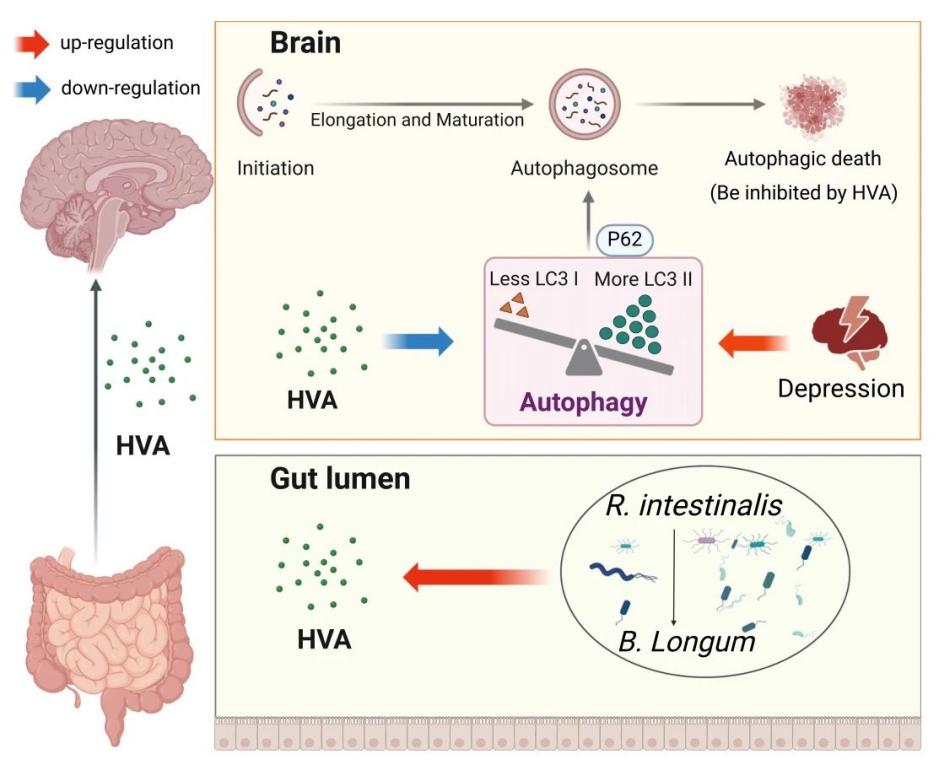
参考文献:Zhao M, Ren Z, Zhao A, et al. Gut bacteria-driven homovanillic acid alleviates depression by modulating synaptic integrity. Cell Metab. 2024;36(5):1000-1012.e6. doi:10.1016/j.cmet.2024.03.010
【绘谱学堂一起学】
学科覆盖广:讲座内容涵盖肠道菌群与宿主互作、癌症微环境调控、心血管代谢机制、神经退行性疾病分子标志物、膳食干预与健康、中药多组学整合分析、畜牧微生物组应用等热点方向。
技术前沿性强:分享多组学联合分析、同位素示踪代谢流技术、代谢网络建模、临床转化研究等创新方法学。
实用价值高:从基础机制探索到转化医学应用,助力研究者提升课题设计能力与数据分析水平。
